研究
食道グループの研究テーマについて
1.食道癌の個別化治療を目指した基礎・臨床研究
- 「食道癌に対するPD-1阻害薬とケモカイン治療併用による抗腫瘍効果増強に関する研究」(若手研究)
ケモカインは細胞遊走と接着を調整する主要因子であり、腫瘍により産生された特定のケモカインは腫瘍増生と転移に寄与しており、他癌腫においては治療標的として報告されている。本研究では、マウス食道癌細胞皮下移植モデルを用いて、ケモカイン標的治療の併用が抗PD-1抗体の抗腫瘍効果を増強するか検証する。 - 「miRNAを用いた食道癌個別化治療の可能性」(若手研究)
新たなバイオマーカーとしてLiquid biopsyが注目されており、血清中のmiRNAが低侵襲で予後予測となりうると報告されている。本研究では、食道がん患者の血清から標的となりうるmiRNAを抽出して臨床転帰を統合し、そのmiRNAの意義を解明する。 - 「人工知能を用いた食道がんの気管・気管支浸潤の診断―診断基準の確立―」(基盤研究C)(一般)
食道癌の気管・気管支浸潤の診断は、治療方針決定・予後判定に重要であるが、従来の検査法では正確な診断は難しい。本研究では、1)臨床例において超音波造影剤を用いて,EBUSの診断能向上の可能性を探索する。加えて,客観性担保のために,2) 深層学習人工知能(Deep learning approach 人工知能)を用いた浸潤診断の新しいシステム構築を行う。 - 「食道癌周術期におけるシンバイオティクス投与による術前化学療法の有害事象や術後感染性合併症の予防効果と栄養指標を用いた周術期栄養評価 シングルアーム・第2相試験」(特定臨床研究)CRB6200001
食道癌周術期におけるシンバイオティクス投与による術前化学療法の有害事象と術後感染性合併症の発症予防効果があることを証明し、さらに、術後の体重減少を軽減することを4つの栄養指標を用いて証明する。また、食道癌治療においてシンバイオティクス投与は、術後再発率を低下させることを証明する。
2.日本食道学会研究課題
日本食道学会では、食道疾患の病態・診断・治療などに関して早急に検討するべき問題点や課題を明らかにして、その解決を図ることにより、食道疾患の診断・治療の進歩を目指しています。当施設は食道外科専門医認定施設として多くの研究課題に参加し、新たなエビデンスの創出に協力しています。
- 2020年度日本食道学会研究課題(研究協力施設)(慶応大学)
食道癌術前化学療法の奏効と再発形式の関連を明らかにするための多施設共同後ろ向き観察研究 - 2022年度日本食道学会研究課題(研究協力施設)(東北大学)
後期高齢者のリンパ節郭清範囲についての現況調査と周術期リスクや予後との関連性の検討 - 2022年度日本食道学会研究課題(研究協力施設)(慶応大学)
食道癌における機械学習を用いた画像認識による術前化学療法および化学放射線療法の効果判定手法確立を目指した多施設共同後ろ向き観察研究 - 2023年度日本食道学会研究課題(研究協力施設)(がん研有明病院)
非根治切除となった食道癌症例に対する術後治療とその治療成績
3.多施設共同研究
最新の知見を取り入れ、いち早く新規治療法を臨床に還元すべく、以下の共同研究に参加しています。
- National Clinical Databaseによる食道癌全国登録を利用した食道癌術後補助療法としてのニボルマブの安全性と有効性に関する観察研究(がん研有明病院)
乳腺
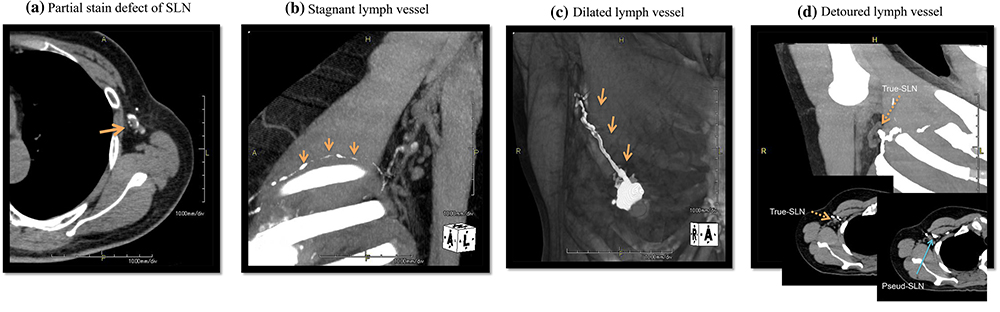
- ●CTリンパ管造影を用いたセンチネルリンパ節の転移診断
-
CTリンパ管造影は術前にセンチネルリンパ節の個数を解剖学的位置とともに知る事が出来る有意義な検査法です。
また、リンパ管やリンパ節の染まり方によってセンチネルリンパ節の転移診断が出来る可能性があり、さらなる低侵襲手術への応用が期待できます。
Preoperative diagnosis of sentinel lymph node (SLN) metastasis using 3D CT lymphography (CTLG).
Breast Cancer (2016) 23:519–524
甲状腺
- ●甲状腺未分化癌同所移植を使用した臨床モデルの作成
- 甲状腺未分化癌の細胞株を免疫不全マウスの甲状腺に移植し、同所移植モデルを作成しています。
作成した同所移植モデルに化学療法を施行し、小動物用PET-CTを用いて腫瘍増殖、抗腫瘍効果を評価しています。 - ●PET-CTにおける甲状腺異常集積症例についての検討
- PET-CTにおける甲状腺癌の異常集積症例について、免疫染色等を行い、予後との関連性について検討を行っています。
肺癌・胸腺腫瘍グループの研究について
肺癌、胸腺上皮性腫瘍の分子生物学的・臨床病理学的研究、肺癌の画像診断に関わる研究を行っています。医学部保健学科(臨床腫瘍医療学分野・医用検査学)、人類遺伝学教室と協力し、以下のような研究活動を行っています。
1. 肺癌・胸腺上皮性腫瘍のエピゲノム異常についての研究
がんにみられる遺伝子異常にはゲノム異常とエピゲノム異常があります。エピゲノム異常のひとつ、DNAメチル化は安定な癌抑制遺伝子不活化の主要な原因の一つとして知られています。私たちのグループでは肺癌や胸腺腫瘍の手術検体のメチル化解析により、癌特異的なメチル化遺伝子について研究しています。
【これまでの主な研究成果】
- ●TRIM58が肺腺癌における新たながん抑制遺伝子と同定
- Kajiura K, Masuda K, Kondo K, Imoto I, et al.
Frequent silencing of the candidate tumor suppressor TRIM58 by promoter methylation in early-stage lung adenocarcinoma.
Oncotarget 8(2): 2890-2905, 2017 - ●GAD1が肺腺癌において異常メチル化を来たすがん遺伝子であることを報告
- Tsuboi M, Kondo K, Masuda K, Imoto I, et al.
Prognostic significance of GAD1 overexpression in patients with resected lung adenocarcinoma.
Cancer Med, 8(9): 4189-4199, 2019 - ●胸腺癌、神経内分泌腫瘍ではRASSF1の腫瘍特異的メチル化がみられることを報告
- Kajiura K, Kondo K, et al.
Frequent silencing of RASSF1A by DNA methylation in thymic neuroendocrine tumours.
Lung Cancer 111: 116-123, 2017 - ●胸腺癌で腫瘍特異的メチル化を来たす複数の遺伝子を同定
- Kishibuchi R, Kondo K, Soejima S, Tsuboi M, Kajiura K, et al.
DNA methylation of GHSR, GNG4, HOXD9 and SALL3 is a common epigenetic alteration in thymic carcinoma.
Int J Oncol 56(1): 315-326, 2020
2. クロム暴露肺癌についての研究
クロムに暴露した労働者に発生した肺癌(クロム肺癌)は、過去にクロム鉱山やめっき加工工場労働者の職業病として知られていました。また、かつて地盤強化を目的にクロム鉱滓を埋め立て、後に無害化処置が行われてからもしばしば環境問題が発生しています。職業性の肺癌として米国では約50万人、世界的には数百万人の労働者が六価クロムに暴露していると言われています。わたしたちの研究グループでは、世界的にみても非常に貴重なクロム肺癌サンプルを保管しており、このサンプルを用いてクロム肺癌にみられる遺伝子異常について研究を行っています。
【これまでの主な研究成果】
クロム肺癌では、通常の肺癌に多くみられる癌抑制遺伝子p53、癌遺伝子Ki-ras, Ha-rasの遺伝子異常の頻度は少ないことがわかりました。ヘテロ接合性消失(LOH:loss of heterozygosity)の解析では第3染色体短腕(3p)のLOHは同程度でした。
Microsatellite instability (MSI)は高頻度で、MSIの頻度とクロム暴露癧の間に相関を認めました。MSIとDNA修復遺伝子hMLH蛋白の発現の低下との間に相関を認め、hMLH蛋白の発現の低下がhMLH1遺伝子のプロモーター領域のメチル化に由来していることを示しました。その他にも、クロム肺癌では色々な癌関連遺伝子(APC, MGMT, p16)のDNAメチル化が多いことがわかりました。
【これまでの主な研究成果】
Kondo K, et al.
Mutations of the p53 gene in human lung cancer from chromate-exposed workers.
Biochem Biophys Res commun 239: 95-100, 1997
Ewis AA, Kondo K, et al.
Occupational cancer genetics: infrequent ras oncogenes point mutations in lung cancer samples from chromate workers.
Am J Ind Med 40: 92-7, 2001
Hirose T, Kondo K, et al.
Frequent microsatellite instability in lung cancer from chromate-exposed workers.
Mol Carcinog 33: 172-180, 2002
Kondo K, et al.
Microscopic analysis of chromium accumulation in the bronchi and lung of chromate workers.
Cancer 98: 2420-9, 2003
Takahashi Y, Kondo K, et al.
Microsatellite instability and protein expression of the DNA mismatch repair gene, hMLH1, of lung cancer in chromate-exposed workers.
Mol Carcinog 42: 150-8, 2005
Takahashi Y, Kondo K, et al.
Microscopic analysis of the chromium content in the chromium-induced malignant and premalignant bronchial lesions of the rat.
Environ Res 99: 267-72, 2005
Kondo K, et al.
The reduced expression and aberrant methylation of p16(INK4a) in chromate workers with lung cancer.
Lung Cancer 53: 295-302, 2006
Ali AH, Kondo K, et al.
Aberrant DNA methylation of some tumor suppressor genes in lung cancers from workers with chromate exposure.
Mol Carcinog 50: 89-99, 2011
Tsuboi M, Kondo K, Soejima S, et al.
Chromate Exposure Induces DNA Hypermethylation of the Mismatch Repair Gene MLH1 in Lung Cancer
Mol Carcinog 59 (1): 24-31, 2020
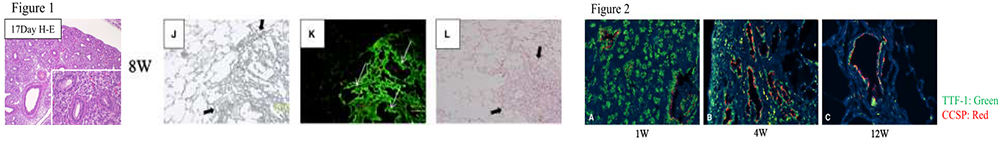
3. 同所性移植肺癌動物モデルの開発とその治療に関する研究
ヒト肺癌細胞株をSCIDマウスの肺に同所性移植することで、臨床における肺癌と酷似したリンパ行性転移様式を示すモデルを確立し、このモデルを用いて研究を行ってきました。
【これまでの主な研究成果】
Ishikura H, Kondo K, Miyoshi T, et al.
Artificial lymphogenous metastatic model using orthotopic implantation of human lung cancer.
Ann Thorac Surg 69: 1691-1695, 2000
Miyoshi T, Kondo K, Ishikura H, et al.
SCID mouse lymphogenous metastatic model of human lung cancer constructed using orthotopic inoculation of cancer cells.
Anticancer Res 20: 161-163, 2000
- ●経口抗癌剤UFTおよび経静脈抗癌剤CDDP投与によるリンパ節転移抑制効果を確認
- Ishikura H, Kondo K, Miyoshi T, et al.
Suppression of Mediastinal Metastasis by Uracil-Tegafur or cis-Diamminedichloroplatinum(II) Using a Lymphogenous Metastatic Model in a Human Lung Cancer Cell Line.
Clin Cancer Res 7: 4202-4208, 2001 - ●分子標的薬剤Matrix metalloproteinase inhibitor MMI-166投与によるリンパ節転移抑制効果を確認
- Fujino H, Kondo K, Ishikura H, et al.
Matrix metalloproteinase inhibitor MMI-166 inhibits lymphogenous metastasis in an orthotopically implanted model of lung cancer.
Mol Cancer Ther 4: 1409-16, 2005 - ●新鮮手術標本より採取した肺癌細胞を初代培養し、SCIDマウスの肺に同所性移植し、臨床における悪性度と類似した性格を有するSCIDマウスモデルを作製
- Fujino H, Kondo K, Miyoshi T, et al.
Establishment of Patient-Like SCID Mouse Model by Orthotopically Implanting Primary Cultured Cells From Surgically-Resected Lung Cancer Tissues.
Oncology reports 10:1709-15, 2003 - ●蛍光色素による転移リンパ節の同定や胸膜播種の同定に利用する研究
-
Takizawa H, Kondo K, et al.
Fluorescence diagnosis of lymph node metastasis of lung cancer in a mouse model.
Oncol Rep. 22: 17-21, 2009.Ali AH, Takizawa H, Kondo K, et al.
5-Aminolevulinic acid-induced fluorescence diagnosis of pleural malignant tumor.
Lung Cancer. 74: 48-54, 2011. - ●肺癌同所性移植モデルと小動物用PET/CT装置を用い、抗癌剤の効果を容易に判定できるpreclinical animal model systemを確立
-
Otani T, Otsuka H, Kondo K, et al.
Utility of respiratory-gated small-animal PET/CT in the chronologic evaluation of an orthotopic lung cancer transplantation mouse model.
Radiological Physics and Technology 8: 266–277, 2015Otani T, Kondo K, et al.
Non‑invasive Monitoring of Cisplatin and Erlotinib Efficacy Against Lung Cancer in Orthotopic SCID Mouse Models by Small Animal FDG‑PET/CT and CT.
Oncol Rep 41 (1): 447-454, 2019
4. 当科で行っている肺がんの臨床研究
当科では肺がんの病期(進行度)診断の精度向上を目的とした臨床研究を行っています。病期診断がより正確になることで、患者さんはより自分に合った治療方法を選択できるようになります。その結果、肺がんの治療成績が向上することが期待されます。
具体的には①胸膜浸潤診断と②リンパ節転移診断の精度向上を目指した術前・術中検査を行っています。胸膜浸潤もリンパ節転移も肺がんの進行度に関わる重要な要素ですが、現在通常行われている検査(CT検査など)では、これらを治療前に正確に診断することは困難と考えられています。
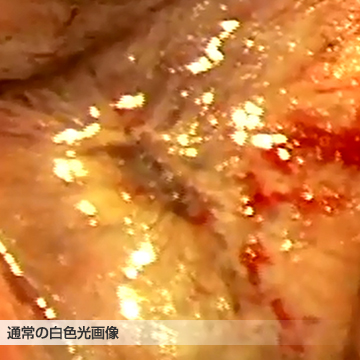
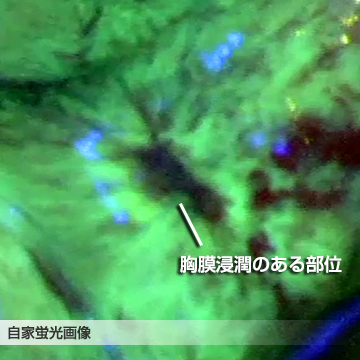
①自家蛍光観察を応用した胸膜浸潤診断
肺は胸膜という薄い膜に包まれていますが、肺の中に発生した肺がんがこの胸膜まで及んでいるかいないか(胸膜浸潤の有無)でがんの進行度が異なってきます。肺がんが胸膜に及ぶ場合や、肺がんが胸膜を破って胸膜の外にまで発育している場合は、より進行した肺がんと考えて治療方法を考える必要があります。しかし、この胸膜浸潤の有無はCT検査などの画像検査ではわからず、手術で肺を切除して初めて診断することができます。この胸膜浸潤の診断を術中に正確に行うことで、手術方法の選択などに利用しようとする試みが、「自家蛍光観察を応用した胸膜浸潤診断」です。
手術中に特殊な波長の光を発する内視鏡装置を用いて、胸膜の表面を観察します。正常の胸膜には自家蛍光が観察されますが、肺がんが浸潤した胸膜には自家蛍光が認められない(図、黒い部分)ことを利用した診断法です。光を当てるだけなので、患者さんへの負担はありません。これまでの研究結果から、手術中に通常の白色光で観察して判断する胸膜診断法より、自家蛍光を用いた診断法の方が明かに正確であることがわかっています。
②術前CTリンパ管造影と術中ICG蛍光法によるセンチネルリンパ節同定
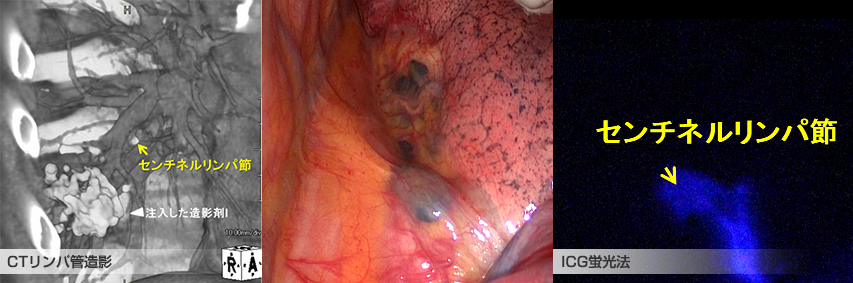
肺がんがリンパ節に転移しているかいないかは、肺がんの進行度を大きく左右します。しかし、リンパ節転移の有無についてはCT検査やPET/CT検査などの画像検査で正確に把握することは難しく、手術患者さんでは術前には転移がないと考えていたのに摘出したリンパ節を組織検査したら転移が見つかった、というようなこともしばしば起こります。このリンパ節転移診断を術前・術中に正確に行うことで、手術方法の選択などに利用しようとする試みが、「センチネルリンパ節同定」です。
センチネルリンパ節とは、がんが最初に転移するリンパ節のことを指し、センチネルリンパ節に転移がなければ、それ以外のリンパ節にも転移がないと考えることができます。気管支鏡で肺がんの近くに造影剤を注入しCTを撮影することで術前にセンチネルリンパ節を同定する検査方法として、術前CTリンパ管造影を行っています。これまでの研究結果から9割程度の患者さんにセンチネルリンパ節を特定することができ、正確なリンパ節転移診断に繋がる可能性が明かになってきています。
また、手術中に肺がんの近くにICGという色素を注入して、特殊な光を当てて色素の流れを見ることでセンチネルリンパ節を同定する方法として、術中ICG蛍光法を行っています。
術前CTリンパ管造影と術中ICG蛍光法を組み合わせることで、より精度の高いセンチネル同定法を実現することを目指しています。
再生グループ
近年、再生医療は様々な領域で注目されています。特にiPS細胞やES細胞を用いた研究の発展は目覚ましく、網膜や心筋などではすでに臨床応用されるまでになりました。
われわれ再生グループは上記3点に関して様々な角度からの基礎研究を通して、将来の医療に少しでも寄与することを目指しています。
1.胎仔肺組織移植モデルを用いた肺の再生に関する研究
胎仔肺組織は、肺への分化が約束された組織であり、動物モデルを用いた基礎研究を通して肺再生のメカニズムに関しての研究を行っています。われわれは、これまでに胎仔肺組織をドナーとして組織移植することで、生体肺だけでなく(Kenzaki. JTCVS 2006)、ブレオマイシン線維症モデル(Toba. JTCVS 2012)、肺気腫モデルマウス(Uyama. J Med Invest)にも生着・分化することを示し、肺への分化を方向づける細胞と間葉系細胞という足場の重要性を示しています。
進行中のプロジェクト
- 「肺organoidを用いた肺細胞・組織移植による肺再生の試み」(基盤C)
- 「胎仔肺組織の生着・分化におけるBipotential細胞の役割」(若手B)
2.局所幹細胞に着目した臓器再生に関する研究
当教室は、肺・縦隔の疾患に加えて、食道・乳腺・甲状腺の疾患を日常臨床では担当させていただいています。各臓器にはそれを構成する成熟細胞に分化する局所幹細胞が存在し、われわれはその局所幹細胞に着目した臓器再生に、横断的に取り組んでいます。
進行中のプロジェクト
- 「iPS細胞から誘導した気管支肺胞幹細胞は障害肺の修復を加速させる」(基盤C)
- 「乳腺幹細胞を用いた乳汁産生機能を有する乳腺の再生」(基盤C)
- 「食道幹細胞を用いた食道の再生」(若手B)
3.肺障害の修復・再生の分子生物学的メカニズムに関する研究
気道・肺胞上皮の再生の道筋は、障害からの修復の過程に類似していることが知られています。われわれは、気道・肺障害モデルを用いて、分子生物学的メカニズムの重要性にも着目し、肺再生の研究に取り組んでいます。
進行中のプロジェクト
- 「気道・肺の障害・修復と再生におけるp53の役割~p53遺伝子改変ブタを用いた研究」(基盤C)
移植免疫・癌免疫
グループでは、第二外科の先輩方がこれまで行ってこられた、 肺移植、移植免疫を基盤として、現在、注目されている癌免疫と 癌微小環境をテーマに研究しています。研究者がトロント大学胸部外科の研究室で習得した、マウスサージェリー(マウス肺移植)の手技を癌、移植免疫を中心とした、あらゆる分野の研究に、応用することを考えています。徳島大学サイクロトロン棟に、Leica製のマイクロスコープや小動物用麻酔器、ベンチレーターを備えて、あらゆるモデルマウスの作製に取り組んでいます。
1. 肺気腫モデルマウスの確立
肺再生後の機能的評価の目的から、遺伝的にalpha-1-antitrypsin の低い、Pallid mouse を長期飼育し、マウスのlife spanである約24ヶ月の中間である12ヶ月ほどで、肺気腫を自然発症させるマウスを海外から購入飼育し、その運動能力、呼吸機能解析、組織像を研究してきました。
この肺気腫モデルマウスは、肺移植実験、肺再生実験、に用いることができ、また、欧米では注目度の高い、alpha-1-antitrypsin欠損モデル、また自然発症の肺気腫モデルとして有用であることを示しました。[1]

BioSystem for Maneuvers, SFT3410 with AUT6100 series BUXCO, Wilmington, NC
また、当科において購入しているBaxco社のプレチスモグラフの原理を用いた呼吸機能解析装置を使用し、小動物の呼吸機能解析を詳細に行える装置を保持しており、モデルマウスの解析の方法論、技術を保持しています。
1. Yoshida M, Sakiyama S, et al. Functional evaluation of pallid mice with genetic emphysema. Lab Invest. 2009; 89(7):760-768.
2. 移植免疫
カナダ、トロント大学胸部外科研究室にて、PTX-3という蛋白に着目した、慢性拒絶反応の研究をしています。肺移植後の急性拒絶反応は現在まであらゆる研究がなされてきましたが、慢性拒絶反応の原因に関しては、不明な点が多く、北米の施設では、現在も様々な研究がなされ、その原因究明に力が注がれています。[2]
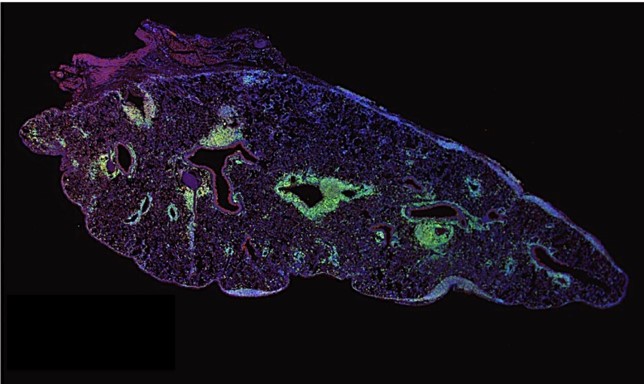
マウス肺移植後の移植肺のT細胞とB細胞の免疫染色の写真です。肺の組織は小宇宙のように見えます。数多くの細胞が、相互に働き合っており、未だ解明されていない事項が多く存在します。
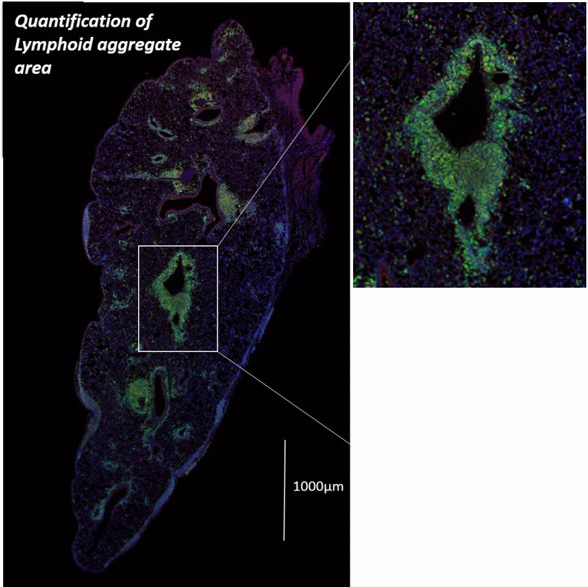
慢性拒絶反応のT細胞の集簇している免疫染色の写真です
2. Yoshida M, Liu M, et al. Pentraxin 3 deficiency enhances features of chronic rejection in a mouse orthotopic lung ransplantation model.
Oncotarget. 2018 Jan 3;9(9):8489-8501.
3. 肺癌同所性移植モデル、肺切除モデルを使用した癌微小環境の探求
肺癌同所移植モデルの技術と、マウス肺移植モデルの技術を組み合わせ、肺癌同所移植マウスへの“抗がん剤、免疫チェックポイント阻害薬投与モデル”や“抗がん剤投与後の肺切除モデル”を作成し、今まで、ヒトの臨床研究ではなし得なかった、癌切除後の長期経過、癌周囲環境、周囲間質の免疫の環境、また、切除肺や残存肺全体の組織学的検索、相互に作用する血中、組織中のサイトカイン、ケモカインなどの蛋白の変化を探求する。
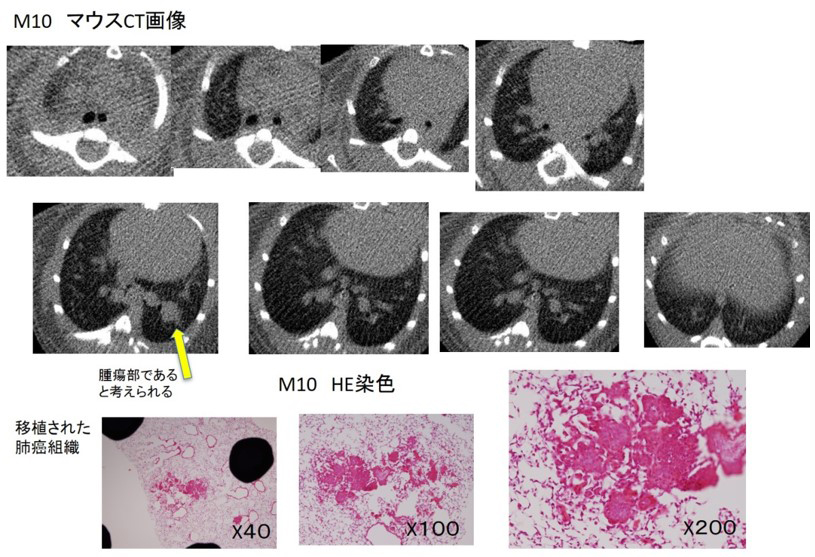
また、これらの探求から、現在の抗癌剤治療に加えて手術療法の真の役割も明らかにしたいと考えています。手術手技を組み合わせることで、ヒトの組織では届かなかった、肺全体の免疫環境を把握できることが可能となれば、各種抗癌剤、免疫チェックポイント阻害剤による、癌とその周囲組織環境変化の詳細、また、癌の組織型別、手術療法を加えること等への様々な治療過程の免疫機構の変化を逐次的に探求可能となり、さらなる個別化治療の飛躍につながると考えています。
4. 今後の研究予定
【探求する癌周囲環境】①腫瘍リンパ管の役割 ②がん関連線維芽細胞の役割 ③マクロファージの働き ④がん幹細胞をとりまく微小環境(ニッチ=がん細胞、免疫細胞、がん間質細胞、血管) ⑤腫瘍内の不均一性、多様性 ⑥間質細胞の不均一性、腫瘍浸潤リンパ球、抗原提示機構APM(antigen processing machinery) ⑦制御性T細胞を中心とした免疫応答、癌微小環境を構成するPDL1自身の構造異常 ⑧TGF-β ⑨細胞オーミクス解析 ⑩造腫瘍性促進機構の解明、MMP(matrix metaroprotease)を標的にしたがん微小環境の制御。ニボルマブ群に関してmultiplex immunofluorescence でcytokeratin - positive tumor cell, CD68+macrophage, FoxP3+ regulatory T cell 、CD8+ Tcell,PD-1+ cell, PDL-1 cell を染め、相互の位置関係、細胞数を確認する。
【遺伝子変異】凍結肺組織は、上記のデータを確認後、ホモジェナイズし、DNA,RNA抽出。主に遺伝子の変異を治療前後で測定し、その変異の状況を確認し、各モデルで、どのような遺伝子が変異しているかを確認したい。これはヒト検体では困難な研究であり、このマウスモデルの研究で肺全体の状況を把握できることが大きな利点である。
上記のような研究を通して、医療への探究心を養い、社会への貢献を目的として、楽しく研究できる環境と有意義な研究を目標として日々取り組んでいます。