肺がん
呼吸器の手術は内視鏡(胸腔鏡)による手術を標準として行っています。側胸部に設けた3~4か所の小さな切開から内視鏡と手術器具を出し入れし、モニターを見ながら行う手術です。昔ながらの開胸手術に比べて傷が小さく体への負担が軽いものと言えます。2018年10月から、肺がんに対する da Vinci Xi によるロボット支援下手術も開始しています。
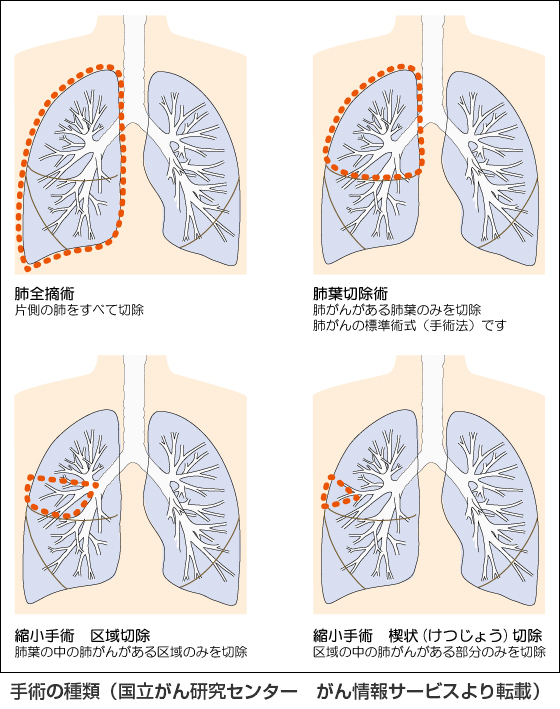
肺は5つの房に分かれています。この房を肺葉と言い、右肺は上葉、中葉、下葉と3つ、対して左肺は上葉、下葉の2つに分かれています。肺がんに対する標準手術はがんの存在する肺葉と周囲のリンパ節を切除する「肺葉切除+リンパ節郭清」です。がんが早期で非常に小さいとき、すなわち肺葉ごと切除しなくても治癒が期待できる場合は肺葉切除より切除範囲を縮小した肺区域切除や肺部分切除を行うこともあります。 また本人の全身状態、特に肺機能が悪くて肺葉切除に耐えられない場合もこれらの縮小手術を行うことがあります。患者さんに合わせた最適の治療を心がけています。
肺がんで手術が可能であるのは進行度Ⅰ期からⅢA期の一部までです。それ以上の進行度の場合は手術ではなく抗がん剤治療が主体となるため呼吸器内科に治療をお願いしています。
 最新の4Kカメラを使用した胸腔鏡手術(モニターも大きくなり従来のカメラよりも鮮明に臓器を映し出せます)
最新の4Kカメラを使用した胸腔鏡手術(モニターも大きくなり従来のカメラよりも鮮明に臓器を映し出せます)
 da Vinci Xiによるロボット支援下手術
da Vinci Xiによるロボット支援下手術
肺がん手術後の経過観察
肺がんの手術後は5年間の経過観察を行います。半年に1回の胸部CT検査、1年に1回の脳MRI検査で再発の有無を調べます。その他適宜血液検査や喀痰細胞診検査、必要な場合はPET-CTで精密検査をすることもあります。大学病院へは基本的に半年に1回の通院ですので普段の細やかな診察はかかりつけ医の先生にお願いしています。その際は県下で統一して作成している「治療の記録ノート」や個々に紹介状をやり取りし、かかりつけの先生と密に連携を取りながら経過を診ていきます。
当科における手術後の成績
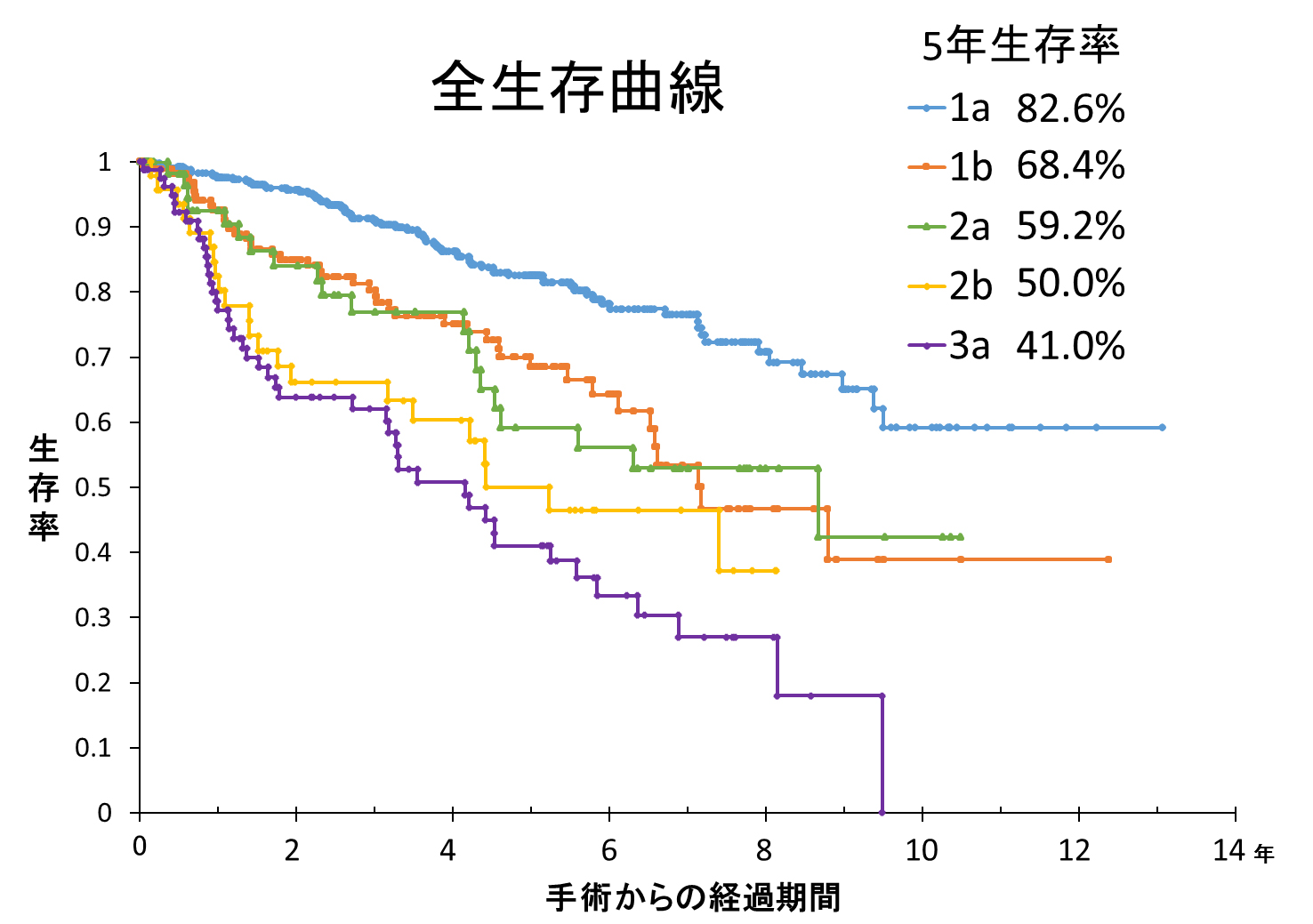
肺がんに限らず多くのがんは手術後5年間の生存をもって成績を比較します。当科の成績は図の通りで、5年生存率は進行度ⅠA期:82.6%、ⅠB期:68.4%、ⅡA期:59.2%、ⅡB期:50.0%、ⅢA期:41.0%、でした。ただしこれは肺がん以外の病気での死亡も含んでの成績です。高齢の患者さんが多ければ多いほどほかの病気で亡くなる割合も増えるため5年生存率は影響を受けます。
肺がんの光線力学療法
当科では以前から光線力学療法(PDT)にも取り組んでいます。PDTとはレーザー治療の一種です。肺がん、食道がん、胃がん、子宮頸がんに保険適用されています。レーザーと言ってもがんを直接焼く治療ではありません。治療に先だって光感受性物質という薬剤を投与します。これは正常組織よりもがん組織に取り込まれやすいという性質があります。そこでレーザーをがんに当てると光感受性物質が光エネルギーを吸収し、化学反応により活性酸素が発生します。それによってがんを破壊するという原理です。
肺がんに対する適応は中心型の早期がんに限られます。中心型とは気管支鏡で見える範囲の太い気管支に発生したものです。なおかつ気管支表層にとどまっていること、2㎝以下、がんの一番奥まで気管支鏡で確認できること、扁平上皮がんであることが挙げられます。具体的な治療の流れですが、まず光感受性物質を点滴投与し、約4時間後に気管支鏡を介してレーザー照射を行います。約30分の治療時間を要するため当科では主に全身麻酔で行っています。
PDTの副作用ですが、光感受性物質はがん以外の正常組織にも取り込まれます。そのため治療後には皮膚に残存した物質が日光や明るい電灯の下で反応し、やけどした様な状態になります。これを防ぐため治療後はやや暗めの室内で過ごしてもらうことが望ましいです。光感受性物質は数日で消失しますので、それまでの間は部屋の明るさを管理するために個室入院としています。
PDTは肺を切除する外科手術とは違い、肺を温存しますので治療後の呼吸機能低下がありません。呼吸機能が悪くて手術できない方、多発している場合や再発例でも繰り返して行えます。ただし適応となるのはあくまで早期の中心型肺がんであり、早期発見が非常に重要です。レントゲンやCTで見つかるものではありませんので、ヘビースモーカーの方、血痰、長引く咳などの症状が続いている方は、痰の細胞検査や気管支鏡検査を受けて頂くのをお勧めします。
当科の年間手術数


当科の取り組み
[ 小型末梢肺病変に対する手術 ]
近年、CTの進歩により胸部写真では指摘できない、画像上すりガラス陰影(Ground Grass Opacity: GGO)を呈する肺腺がんが増加しています。多くは非浸潤がんもしくは微小浸潤がんであり、非常に予後良好であることが報告されています(Am J Surg Pathol 2009)。
さらに、低線量CTを用いた検診が肺がんの死亡率を低下させたという報告が出たことからも(N Engl J Med 2011)、今後このような病変が発見される機会が増加すると予想されます。すでに早期肺がんのCT所見に関する前向き研究(JCOG0201)がなされ、2㎝以下で、consolidation/tumor ratio≦25%のGGO病変が特異度98.7%で早期肺がんであることが証明されました(J Thorac Oncol 2011)。さらに、CT上早期肺がんと考えられる病変に対する縮小手術の有用性に関する第II相試験(JCOG0804/WJ4507L)もすでに症例集積が終了し、今後の流れとしては、CT上早期肺がんの疑われる病変に関しての縮小手術はコンセンサスが得られることが予想されています。
一方で、これらの病変の多くは胸腔鏡のみで正確に場所を同定することは困難で、小さな手術創から手を入れて触診することも不可能であるため、切除の際には何らかのマーキングが必要になってきます。術前に経皮的に病変部近傍にフックワイヤーを留置し、それを目印に胸腔鏡下に切除するという方法を採用している施設が多いです。当科でも当初はその方法を採用していましたが、空気塞栓による死亡例を経験して以来(Sakiyama S, et al. JTCVS 2003)、われわれは、これらの病変に対して、CTガイド下に気管支鏡を用いて経気管支的に腫瘍の近傍に血管塞栓用コイルを留置し、後日胸腔鏡下にCアーム透視下に切除するという独自の方法を開発し、症例を重ねています(Toba H, et al. EJCTS 2013)。当科ではすでに2017年8月までに144例(157病変)に対して、本法を施行し、合併症は1例(0.7%)のみ軽度の気胸を認めたのみと安全に施行できており、全例で術中にコイルを確認し、十分なマージンをもって切除できています。本法のメリットとして、①手技が安全で合併症が少ない、②完全鏡視下に確実に病変を同定・切除できる、③多発病変にも対応できる、などがあります。さらにはCT上早期肺がんと考えられる73例に対しても十分なマージンをとった切除ができており、全例で局所再発は認めておらず、根治性を担保するために必要不可欠な方法となっています。
悪性胸膜中皮腫
悪性中皮腫は、肺の周囲を覆う膜(胸膜)に発生する稀なタイプの悪性腫瘍で、アスベストの吸入が発生原因とされています。アスベストの吸入から中皮腫を発生するまでに平均で約40年かかるとされており、現在日本でもその患者数は増加しています。主な症状は息切れ、胸部痛などですが、この病気に特徴的な症状は少なく、胸部レントゲンや胸部CT検査で胸水貯留を認めることが多いです。診断を確定するためには胸腔鏡検査といって、胸腔内をカメラで観察しながら特殊な器具で胸膜を採取し、顕微鏡検査を行うことで確定されます。
治療は病期によって、手術、放射線療法、化学療法を組み合わせて行います。手術は病気の拡がりによって、胸膜のみを切除するもの(胸膜切除・肺剥皮術)と、胸膜および片肺を全て切除するもの(胸膜肺全摘術)のいずれかが行われます。難治性悪性腫瘍の一つであり、単一の治療では治癒することが難しいため、外科医、呼吸器内科医、放射線科医などの集学的チームで治療方針について話し合うことがガイドラインでも勧められています。当院も3科で合同カンファレンスを行い、個々の症例に応じた治療を行っています。
肺がん学会ホームページ肺がん診療ガイドラインを参照ください。








